ある液体に1つ以上の物質が溶けた混合物のことを溶液(solution)という。
このときの液体を溶媒(solvent)、溶けた物質を溶質(solute)という。
では、溶けるとは具体的にどういうことなのか。
水分子の極性
水分子は水素(H)と酸素(O)の電気陰性度(分子内の原子が電子を引き寄せる強さを表すものさし)の違いによって極性が生じることを学びました。
HよりもOのほうが電気陰性度が大きいため、水分子ではOがわずかにマイナスの電荷を帯び、Hがわずかにプラスの電荷を帯びます。
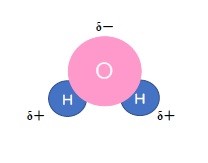
このことが、水にものが溶けるという現象の鍵となります。
塩化ナトリウムの場合
塩化ナトリウム(NaCl)を水に入れてかき混ぜると食塩水ができます。
このとき溶質はNaCl、溶媒は水、できた溶液は食塩水となります。
NaClは水中で電離しNa+とCl-になります。
物質が水の中で分離して陽イオンと陰イオンに分かれることを電離といいいます。
そこに水分子のδ-部分とδ+部分が近づいてきます。
Na+にはδ-部分が、Cl-にはδ+部分がそれぞれイオンを取り囲むようにくっついてNa+とCl-は引き離され、拡散していきます。
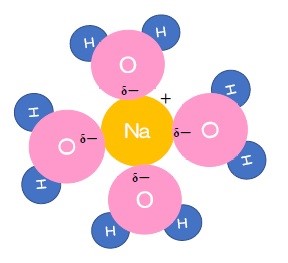
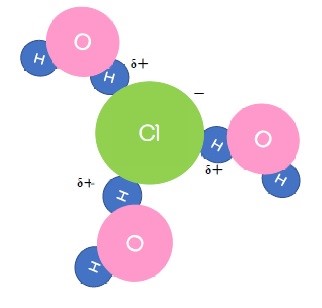
このようにイオンが溶媒によって引き離される現象を「溶ける」といいます。
特に溶媒が水の場合は水和といい、水和によって水中で不安定になっているイオンが中和され、安定して存在できるようになるのです。
塩化水素の場合
塩化水素(HCl)を水に溶かすと塩酸になります。
ここで注意しなければならないのは溶質である塩化水素(気体)も溶液である塩酸も化学式は同じHClであるということ。溶液であることをわかりやすくするため、塩酸をHCl(aq)と表記します。
HClは水中ではどのようになっているでしょうか。
HClはH+とCl-に電離しますが、H+はとても不安定な状態であるため水中で存在することができません。すぐに水分子と結合し、オキソニウムイオンH3O+となって存在します。
塩酸の中では塩酸はほぼ完全に陽イオンと陰イオンに電離しています。
HCl + H2O → H3O+ + Cl-
まとめ
ものが液体(溶媒)に溶けるとは、物質を構成する分子が電離して陽イオンと陰イオンになり、溶媒によって引き離されること。
このことは、いま学んでいるクロマトグラフィーでも重要なポイントになるのではないかと思います。
非臨床試験では、薬効を解析するための投与液(溶媒対照)を作るときに使う液体をvehicleといい、その液体を投与する試験群をvehicle controlと呼んでいたのを思い出しました。 初めてその用語を見たときは乗り物?と不思議に思いましたが、vehicleには媒介するもの、とか伝達するものという意味がありますので納得です。



コメント