分子間力の1つである水素結合について復習しました。
水素結合とは
前回、電気陰性度について学んだことを書いたとき、水素結合について少し触れています。
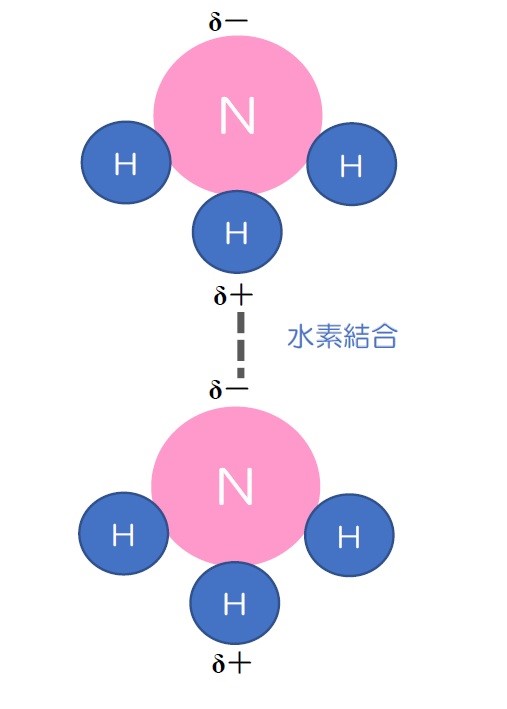
水素結合は、電気陰性度が大きいフッ素、酸素、窒素に共有結合で結びついた水素と、近傍に位置するフッ素、酸素、窒素の孤立電子対が引き合って作られる結合です。
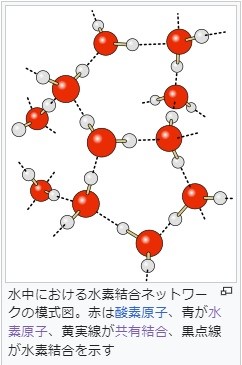
水分子(H2O)の場合、電気陰性度の差から電子は酸素側に偏ります。
その結果、H2Oの酸素側にはマイナスの電荷(δ-)が、水素側にはプラスの電荷(δ+)が生じます。
これを分極といいます。 このように分極した水素H(δ+)が近くにある酸素O(δ-)とクーロン力によって引き合い、安定化します。
ところが、塩化水素(HCl)は同様に分極しますが水素結合を作りません。
その理由を調べてみました。
電荷密度の違い
フッ素、酸素、窒素の電気陰性度はそれぞれ4.0、3.4、3.0です。塩素の電気陰性度は窒素とほぼ同じく3.2です。
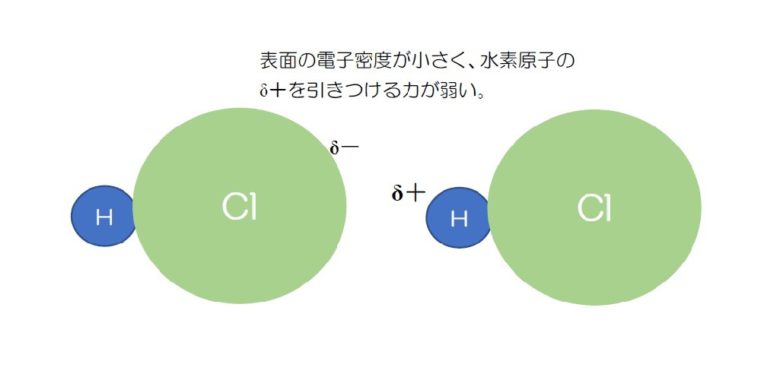
しかし、水素結合を作る窒素NH3の場合、Nの最外殻はM殻ですが、HClの場合、Clの最外殻はL殻になります。
つまり、Clの方がNよりも原子の表面積が大きいのです。
Hと共有結合を作ったときの最外殻電子数はどちらも8個ですが、原子の表面積が大きいClでは最外殻の電子の密度がNよりも小さくなります。 その結果、Hとの結合力は弱くなります。
まとめ
塩素は原子の表面積が大きいため電荷密度が小さくなり、水素原子を引きつける力が弱くなる。そのため、塩化水素は水素結合を作らない。
一見複雑に見える化学結合も、電子配置の基本がわかれば理解しやすくなります。



コメント